Penggunaan pertama istilah "antibodi"
terjadi dalam teks dengan Paul Ehrlich. The Antikörper jangka (kata Jerman
untuk antibodi) muncul dalam kesimpulan dari artikelnya "Studi
Eksperimental pada Kekebalan", diterbitkan pada bulan Oktober 1891, yang
menyatakan bahwa, "jika dua zat menimbulkan dua antikörper yang berbeda,
maka mereka sendiri harus berbeda ". Namun, istilah itu tidak diterima
segera dan beberapa istilah lain untuk antibodi diusulkan; ini termasuk
Immunkörper, Amboceptor, Zwischenkörper, sensibilisatrice substansi, kata kerja
penghubung, Desmon, philocytase, fixateur, dan Immunisin. Kata antibodi
memiliki analogi resmi kepada antitoksin kata dan konsep yang mirip dengan
Immunkörper (kekebalan tubuh dalam bahasa Inggris). Dengan demikian, konstruksi
asli dari kata tersebut mengandung cacat logis; antitoksin adalah sesuatu yang
ditujukan terhadap racun, sedangkan antibodi adalah badan diarahkan terhadap
sesuatu.
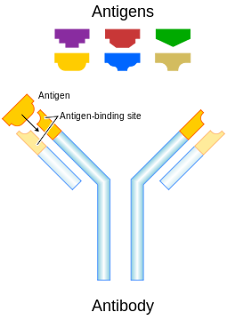
Antibodi (Ab), juga dikenal sebagai immunoglobulin (Ig), (bahasa
Inggris: antibody, gamma globulin)
adalah besar, protein berbentuk Y yang diproduksi terutama oleh sel-sel plasma
yang digunakan oleh sistem kekebalan tubuh untuk mengidentifikasi dan
menetralisir patogen seperti bakteri dan virus. antibodi mengenali molekul yang
unik dari agen berbahaya, yang disebut antigen, melalui wilayah variabel Fab
ini. Setiap ujung "Y" dari antibodi berisi paratope (analog dengan
kunci) yang spesifik untuk satu epitop tertentu (sama analog dengan kunci) pada
antigen, memungkinkan dua struktur ini untuk mengikat bersama-sama dengan
presisi. Menggunakan mekanisme yang mengikat ini, antibodi dapat tag mikroba
atau sel yang terinfeksi serangan oleh bagian lain dari sistem kekebalan tubuh,
atau bisa menetralisir target langsung (misalnya, dengan memblokir bagian dari
mikroba yang penting untuk invasi dan kelangsungan hidup ). Tergantung pada
antigen, yang mengikat dapat menghambat proses biologis yang menyebabkan
penyakit atau dapat mengaktifkan makrofag untuk menghancurkan zat asing.
Kemampuan antibodi untuk berkomunikasi dengan komponen lain dari sistem
kekebalan tubuh dimediasi melalui wilayah Fc nya (terletak di dasar dari
"Y"), yang berisi situs glikosilasi dilestarikan terlibat dalam
interaksi tersebut. Produksi antibodi adalah fungsi utama dari sistem imun
humoral. Antibodi dapat ditemukan pada darah atau kelenjar tubuh vertebrata
lainnya, dan digunakan oleh sistem kekebalan tubuh untuk mengidentifikasikan
dan menetralisasikan benda asing seperti bakteri dan virus. Tiap antibodi memiliki dua rantai berat besar dan dua rantai
ringan.
Antibodi disekresikan oleh sel B dari sistem imun adaptif,
sebagian besar oleh sel B dibedakan disebut sel plasma. Antibodi dapat terjadi dalam dua bentuk fisik, bentuk terlarut yang
disekresikan dari sel untuk bebas dalam plasma darah, dan bentuk terikat
membran yang melekat pada permukaan sel B dan disebut sebagai sel B reseptor
(BCR). BCR hanya ditemukan pada permukaan sel B dan memfasilitasi aktivasi
sel-sel ini dan diferensiasi selanjutnya mereka menjadi baik pabrik antibodi
yang disebut sel plasma atau sel memori B yang akan bertahan dalam tubuh dan
ingat bahwa antigen yang sama sehingga sel-sel B dapat merespon lebih cepat
setelah terpapar masa depan. Dalam kebanyakan kasus, interaksi sel B dengan sel
T helper diperlukan untuk menghasilkan aktivasi penuh sel B dan, oleh karena
itu, generasi antibodi berikut antigen mengikat. antibodi larut dilepaskan ke
dalam darah dan jaringan cairan, serta banyak sekresi untuk terus survei untuk
serangan mikroorganisme.
Antibodi adalah glikoprotein milik superfamili
imunoglobulin. Mereka merupakan sebagian dari fraksi gamma globulin protein
darah. Mereka biasanya terbuat dari unit-masing struktur dasar dengan dua
rantai berat besar dan dua rantai ringan kecil. Ada beberapa jenis rantai berat
antibodi yang mendefinisikan lima jenis fragmen crystallisable (Fc) yang
mungkin melekat pada fragmen antigen-binding. Lima jenis yang berbeda dari
daerah Fc memungkinkan antibodi untuk dikelompokkan menjadi lima isotipe.
Setiap daerah Fc dari isotype antibodi tertentu mampu mengikat nya Fc Receptor
tertentu (kecuali untuk IgD, yang pada dasarnya adalah BCR), sehingga
memungkinkan kompleks antigen-antibodi untuk menengahi peran yang berbeda tergantung
pada FCR ia mengikat. Kemampuan antibodi untuk mengikat FCR yang sesuai
selanjutnya dipengaruhi oleh struktur glikan (s) hadir di situs dilestarikan di
wilayah Fc nya. Kemampuan antibodi untuk mengikat FcRs membantu untuk
mengarahkan respon imun yang tepat untuk setiap jenis yang berbeda dari benda
asing yang mereka hadapi. Misalnya, IgE bertanggung jawab untuk reaksi alergi
yang terdiri dari degranulasi sel mast dan pelepasan histamin. IgE ini Fab
paratope mengikat antigen alergi, untuk partikel tungau misalnya debu rumah,
sementara wilayah Fc yang mengikat Fc reseptor ε. Interaksi alergen-IgE-FcRε
menengahi transduksi sinyal alergi untuk menginduksi kondisi seperti asma.
Meskipun struktur umum dari semua antibodi sangat
mirip, daerah kecil di ujung protein sangat bervariasi, yang memungkinkan
jutaan antibodi dengan struktur ujung yang sedikit berbeda, atau situs antigen
mengikat, ada. Wilayah ini dikenal sebagai wilayah hypervariable. Masing-masing
varian ini dapat mengikat antigen yang berbeda. keragaman besar ini paratopes
antibodi pada fragmen antigen-binding memungkinkan sistem kekebalan tubuh untuk
mengenali berbagai sama macam antigen. Populasi besar dan beragam paratope
antibodi yang dihasilkan oleh peristiwa acak rekombinasi dari serangkaian
segmen gen yang mengkode situs antigen mengikat yang berbeda (atau paratopes),
diikuti oleh mutasi acak di daerah ini dari gen antibodi, yang menciptakan
keragaman lanjut. Proses rekombinasi ini yang menghasilkan klon keragaman
paratope antibodi yang disebut V (D) J atau VJ rekombinasi. Pada dasarnya,
paratope antibodi poligenik, terdiri dari tiga gen, V, D, dan J. Setiap lokus
paratope juga polymorphic, sehingga selama produksi antibodi, satu alel dari V,
salah satu D, dan salah satu J dipilih. segmen gen ini kemudian bergabung
bersama-sama menggunakan rekombinasi genetik acak untuk menghasilkan paratope
tersebut. Daerah di mana gen secara acak digabungkan bersama-sama adalah variabel
daerah hiper digunakan untuk mengenali antigen yang berbeda secara klonal.
gen antibodi juga mengatur kembali dalam proses
yang disebut kelas switching yang mengubah satu jenis rantai berat Fc fragmen
lain, menciptakan isotype berbeda dari antibodi yang mempertahankan wilayah
variabel antigen spesifik. Hal ini memungkinkan antibodi tunggal untuk
digunakan oleh berbagai jenis reseptor Fc, menyatakan pada bagian yang berbeda
dari sistem kekebalan tubuh.
BENTUK
Bentuk membran-terikat antibodi dapat disebut
immunoglobulin permukaan (SIG) atau imunoglobulin membran (MIG). Ini adalah
bagian dari reseptor sel B (BCR), yang memungkinkan sel B untuk mendeteksi
ketika antigen tertentu hadir dalam tubuh dan memicu aktivasi sel B. BCR
terdiri dari IgD permukaan-terikat atau antibodi IgM dan terkait Ig-α dan
heterodimers Ig-β, yang mampu transduksi sinyal. Sebuah sel B manusia biasa
memiliki 50.000 sampai 100.000 antibodi terikat ke permukaan. Setelah antigen
mengikat, mereka berkelompok di patch besar, yang dapat melebihi 1 mikrometer
diameter, pada rakit lipid yang mengisolasi BCRs dari sebagian sel sinyal
reseptor lainnya. Patch ini dapat meningkatkan efisiensi kekebalan response.In
manusia seluler, permukaan sel telanjang sekitar reseptor sel B untuk beberapa
ratus nanometer, yang selanjutnya mengisolasi BCRs dari pengaruh bersaing.
Interaksi
Antigen-Antibodi
Paratope antibodi berinteraksi dengan epitop
antigen. Antigen biasanya mengandung epitop yang berbeda sepanjang permukaannya
diatur terputus-putus, dan epitop dominan pada antigen tertentu disebut
penentu.
Antibodi dan antigen berinteraksi dengan melengkapi
tata ruang (terkunci). Kekuatan molekul yang terlibat dalam interaksi
Fab-epitop lemah dan non-spesifik - misalnya gaya elektrostatik, ikatan
hidrogen, interaksi hidrofobik, dan pasukan van der Waals. Ini berarti mengikat
antara antibodi dan antigen adalah reversibel, dan afinitas antibodi terhadap
antigen relatif bukan absolut. Relatif lemah mengikat juga berarti ada
kemungkinan untuk antibodi untuk bereaksi silang dengan antigen yang berbeda
dari afinitas relatif berbeda.
Seringkali, setelah antibodi dan antigen mengikat,
mereka menjadi kompleks imun, yang berfungsi sebagai objek kesatuan dan dapat
bertindak sebagai antigen dalam dirinya sendiri, yang dimentahkan oleh antibodi
lainnya. Demikian pula, haptens adalah molekul kecil yang memprovokasi ada
respon imun sendiri, tetapi setelah mereka mengikat protein, yang dihasilkan
kompleks atau hapten-carrier adduct adalah antigenik.
Antibodi dapat datang dalam varietas yang berbeda yang
dikenal sebagai isotipe atau kelas. Pada mamalia plasenta ada lima isotipe
antibodi yang dikenal sebagai IgA, IgD, IgE, IgG, dan IgM. Mereka masing-masing
bernama dengan "Ig" awalan yang berdiri untuk imunoglobulin, nama kadang-kadang
digunakan bergantian dengan antibodi, dan berbeda dalam sifat biologis mereka,
lokasi fungsional dan kemampuan untuk menangani antigen yang berbeda, seperti
yang digambarkan dalam tabel. Akhiran yang berbeda dari isotipe antibodi
menunjukkan berbagai jenis rantai berat antibodi mengandung, dengan
masing-masing kelas berat rantai bernama abjad: α (alpha), γ (gamma), δ
(delta), ε (epsilon), dan μ (mu ). Hal ini menimbulkan IgA, IgG, IgD, IgE, dan
IgM, masing-masing.
Antibodi isotype dari perubahan sel B selama
pengembangan sel dan aktivasi. sel B yang belum matang, yang belum pernah
terkena antigen, mengungkapkan hanya isotipe IgM dalam bentuk terikat permukaan
sel. The B limfosit, dalam bentuk siap merespon, dikenal sebagai "limfosit
B naif." B limfosit naif mengungkapkan baik IgM permukaan dan IgD.
Co-ekspresi kedua ini isotipe imunoglobulin menjadikan sel B siap untuk
menanggapi antigen. aktivasi sel B berikut keterlibatan molekul antibodi
sel-terikat dengan antigen, menyebabkan sel untuk membelah dan berdiferensiasi
menjadi sel yang memproduksi antibodi yang disebut sel plasma. Dalam bentuk
diaktifkan ini, sel B mulai memproduksi antibodi dalam bentuk disekresikan
daripada bentuk membran-terikat. Beberapa sel anak dari sel B yang teraktivasi
menjalani isotipe switching, mekanisme yang menyebabkan produksi antibodi untuk
mengubah dari IgM atau IgD ke isotipe antibodi lainnya, IgE, IgA, atau IgG,
yang telah ditetapkan peran dalam sistem kekebalan tubuh.
Isotipe Antibodi Tidak Ditemukan Pada Mamalia
|
||
Name
|
Tipe
|
Diskripsi
|
IgY
|
Ditemukan pada burung dan
reptil; terkait dengan mamalia IgG.
|
|
IgW
|
Ditemukan di hiu (Ikan
bertulang rawan); terkait dengan mamalia IgG.
|
|
Struktur
Antibodi yang berat (~ 150 kDa) globular protein
plasma. Mereka memiliki rantai gula (glycans) ditambahkan ke residu asam amino
dilestarikan. Dengan kata lain, antibodi adalah glikoprotein. glycans terlampir
adalah sangat penting untuk struktur dan fungsi antibodi. Antara lain glycans
dinyatakan dapat memodulasi afinitas antibodi untuk FCR yang sesuai (s).
Unit fungsional dasar dari setiap antibodi
immunoglobulin (Ig) monomer (yang hanya berisi satu unit Ig); antibodi yang
disekresikan juga bisa dimer dengan dua unit Ig seperti IgA, tetrameric dengan
empat unit Ig seperti ikan teleost IgM, atau pentameric dengan lima unit Ig,
seperti mamalia IgM.
Immunoglobulin adalah "Y" berbentuk
molekul yang terdiri dari empat rantai polipeptida; dua rantai berat identik
dan dua rantai ringan identik dihubungkan oleh ikatan disulfida. Setiap rantai
terdiri dari domain struktural yang disebut immunoglobulin domain. Domain ini
mengandung sekitar 70-110 asam amino dan diklasifikasikan ke dalam kategori
yang berbeda (misalnya, variabel atau IGV, dan konstan atau IGC) sesuai dengan
ukuran dan fungsi mereka. Mereka memiliki imunoglobulin kali lipat
karakteristik di mana dua lembar beta membuat bentuk "sandwich", yang
diselenggarakan bersama oleh interaksi antara sistein dilestarikan dan asam
amino lainnya dikenakan.
Ada lima jenis mamalia Ig rantai berat dilambangkan
dengan huruf Yunani: α, δ, ε, γ, dan μ. Jenis rantai hadir berat mendefinisikan
kelas antibodi; rantai ini ditemukan di IgA, IgD, IgE, IgG, dan IgM,
masing-masing. rantai berat yang berbeda berbeda dalam ukuran dan komposisi; α
dan γ mengandung sekitar 450 asam amino,
sedangkan μ dan ε memiliki sekitar 550 asam amino.
Untuk detail lebih lanjut tentang topik ini, lihat
rantai ringan Immunoglobulin.
 Pada mamalia ada dua jenis rantai ringan, yang
disebut lambda (λ) dan kappa (κ). Sebuah rantai cahaya memiliki dua domain
berturut: satu domain konstan dan satu domain variabel. Perkiraan lama rantai
cahaya 211-217 asam amino. Setiap antibodi berisi dua rantai ringan yang selalu
identik; hanya satu jenis rantai ringan, κ atau λ, hadir per antibodi pada
mamalia. Jenis lain dari rantai ringan, seperti sedikitpun (ι) rantai,
ditemukan pada vertebrata lain seperti hiu (Chondrichthyes) dan ikan bertulang
(Teleostei).
Pada mamalia ada dua jenis rantai ringan, yang
disebut lambda (λ) dan kappa (κ). Sebuah rantai cahaya memiliki dua domain
berturut: satu domain konstan dan satu domain variabel. Perkiraan lama rantai
cahaya 211-217 asam amino. Setiap antibodi berisi dua rantai ringan yang selalu
identik; hanya satu jenis rantai ringan, κ atau λ, hadir per antibodi pada
mamalia. Jenis lain dari rantai ringan, seperti sedikitpun (ι) rantai,
ditemukan pada vertebrata lain seperti hiu (Chondrichthyes) dan ikan bertulang
(Teleostei).
1.
Wilayah fab
2.
Wilayah fc
3.
Rantai berat (biru) dengan satu variabel (vh)
domain diikuti oleh domain konstan (ch1), daerah engsel, dan dua konstan lebih
(ch2 dan ch3) domain
4.
Rantai ringan (hijau) dengan satu variabel (vl) dan
satu konstan (cl) domain
5.
Antigen binding site (paratope)
6.
Daerah sendi
Setiap rantai berat memiliki dua daerah, wilayah
konstan dan wilayah variabel. Wilayah konstan adalah identik dalam semua
antibodi dari isotipe yang sama, tetapi berbeda dalam antibodi dari isotipe
yang berbeda. rantai berat y, α dan δ memiliki wilayah yang konstan terdiri
dari tiga tandem (dalam garis) domain Ig, dan daerah engsel untuk fleksibilitas
ditambahkan; rantai berat μ dan ε memiliki wilayah yang konstan terdiri dari
empat domain imunoglobulin. Wilayah variabel rantai berat berbeda dalam
antibodi diproduksi oleh sel B yang berbeda, tetapi adalah sama untuk semua
antibodi yang dihasilkan oleh sel B tunggal atau sel klon B. Wilayah variabel
masing-masing rantai berat sekitar 110 asam amino panjang dan terdiri dari
domain Ig tunggal.
CDR,
Fv, Fab dan Fc daerah
Beberapa bagian dari antibodi memiliki fungsi yang
sama. Lengan dari Y, misalnya, berisi situs yang dapat mengikat antigen (pada
umumnya, identik) dan, karena itu, mengenali benda asing tertentu. wilayah ini
dari antibodi yang disebut sebagai daerah Fab (fragmen, antigen-binding). Hal
ini terdiri dari satu konstan dan satu domain variabel dari masing-masing
rantai berat dan ringan dari antibodi. paratope ini berbentuk di terminal akhir
amino dari monomer antibodi dengan domain variabel dari rantai berat dan
ringan. Domain variabel juga disebut sebagai wilayah FV dan merupakan daerah
yang paling penting untuk mengikat antigen. Untuk lebih spesifik, loop variabel
β-helai, masing-masing tiga lampu (VL) dan berat (VH) rantai bertanggung jawab
untuk mengikat antigen. Loop ini disebut sebagai saling melengkapi menentukan
daerah (CDRs). Struktur CDR ini telah berkerumun dan diklasifikasikan oleh
Chothia et al. dan baru-baru oleh Utara et al. dan Nikoloudis et al. Dalam
rangka teori jaringan kekebalan tubuh, CDR juga disebut idiotypes. Menurut
teori jaringan kekebalan tubuh, sistem imun adaptif diatur oleh interaksi
antara idiotypes.
Dasar Y berperan dalam memodulasi aktivitas sel
kekebalan tubuh. wilayah ini disebut Fc (Fragmen, dikristalisasi) wilayah, dan
terdiri dari dua rantai berat yang berkontribusi dua atau tiga domain konstan
tergantung pada kelas antibodi. Dengan demikian, wilayah Fc memastikan bahwa
setiap antibodi menghasilkan respon imun yang tepat untuk antigen tertentu,
dengan mengikat kelas tertentu dari reseptor Fc, dan molekul kekebalan lainnya,
seperti protein komplemen. Dengan melakukan ini, itu memediasi efek fisiologis
yang berbeda termasuk pengakuan partikel opsonized (mengikat FcγR), lisis sel
(mengikat untuk), dan degranulasi sel mast, basofil, dan eosinofil (mengikat
FcεR).
Singkatnya, wilayah Fab antibodi menentukan antigen
spesifisitas sementara wilayah Fc dari antibodi menentukan efek kelas antibodi.
Karena hanya domain konstan dari rantai berat membuat wilayah Fc dari antibodi,
kelas dari rantai berat di antibodi menentukan efek kelas mereka. kelas mungkin
dari rantai berat di antibodi termasuk alpha, gamma, delta, epsilon, dan mu,
dan mereka menentukan isotipe antibodi IgA, G, D, E, dan M, masing-masing. Ini
menyimpulkan isotipe yang berbeda dari antibodi memiliki efek kelas yang
berbeda karena daerah Fc yang berbeda mereka mengikat dan mengaktifkan berbagai
jenis reseptor. efek kelas yang mungkin antibodi meliputi: opsonisasi,
aglutinasi, hemolisis, aktivasi melengkapi, degranulasi sel mast, dan
netralisasi (meskipun efek kelas ini dapat dimediasi oleh daerah Fab daripada
wilayah Fc). Hal ini juga menyiratkan bahwa efek Fab-dimediasi diarahkan pada
mikroba atau racun, sementara Fc efek dimediasi diarahkan pada sel efektor atau
molekul efektor (lihat di bawah).
DIAGNOSIS
PENYAKIT
Deteksi antibodi tertentu adalah bentuk yang sangat
umum dari diagnosa medis, dan aplikasi seperti serologi tergantung pada metode
ini. Misalnya, dalam tes biokimia untuk diagnosis penyakit, titer antibodi yang
ditujukan terhadap virus
Epstein-Barr atau penyakit Lyme diperkirakan dari darah. Jika antibodi yang
tidak hadir, baik orang tersebut tidak terinfeksi atau infeksi terjadi waktu
yang sangat lama, dan sel-sel B menghasilkan antibodi spesifik telah secara
alami membusuk.
Dalam imunologi klinis, tingkat kelas individu
imunoglobulin yang diukur dengan nephelometry (atau turbidimetri) untuk
mencirikan profil antibodi pasien. Ketinggian di kelas yang berbeda dari
imunoglobulin kadang-kadang berguna dalam menentukan penyebab kerusakan hati
pada pasien untuk siapa diagnosis tidak jelas. Misalnya, peningkatan IgA
menunjukkan sirosis alkoholik, peningkatan IgM menunjukkan virus hepatitis dan
sirosis bilier primer, sedangkan IgG meningkat pada hepatitis virus,
hepatitis autoimun dan sirosis.
Gangguan autoimun sering dapat ditelusuri ke
antibodi yang mengikat epitop tubuh sendiri; banyak dapat dideteksi melalui tes
darah. Antibodi terhadap antigen permukaan sel darah merah dalam kekebalan
tubuh dimediasi anemia hemolitik terdeteksi dengan tes Coombs. Tes Coombs juga
digunakan untuk skrining antibodi dalam persiapan transfusi darah dan juga
untuk skrining antibodi pada wanita antenatal.
Praktis, beberapa metode immunodiagnostic
berdasarkan deteksi antigen-antibodi yang digunakan untuk mendiagnosa penyakit
menular, misalnya ELISA, immunofluorescence, Western blot, immunodiffusion,
immunoelectrophoresis, dan immunoassay magnetik. Antibodi diajukan terhadap
human chorionic gonadotropin digunakan di lebih dari tes kehamilan counter.
New dioxaborolane kimia memungkinkan radioaktif
fluoride (18F) pelabelan antibodi, yang memungkinkan untuk tomografi emisi
positron (PET) pencitraan kanker.
Terapi
Penyakit
Terapi antibodi monoklonal yang ditargetkan
digunakan untuk mengobati penyakit seperti rheumatoid arthritis, multiple
sclerosis, psoriasis, dan berbagai bentuk kanker termasuk limfoma non-Hodgkin,
kanker kolorektal, kanker kepala dan leher dan kanker payudara.
Beberapa defisiensi imun, seperti agammaglobulinemia
X-linked dan hypogammaglobulinemia, mengakibatkan kurangnya sebagian atau
lengkap antibodi. Penyakit ini sering diperlakukan dengan menginduksi bentuk
jangka pendek imunitas disebut imunitas pasif. imunitas pasif dicapai melalui
transfer antibodi siap pakai dalam bentuk serum manusia atau hewan, pooled
immunoglobulin atau antibodi monoklonal, ke individu yang terkena.
Terapi
Prenatal
Faktor rhesus, yang juga dikenal sebagai Rhesus D
(RhD) antigen, merupakan antigen yang ditemukan pada sel-sel darah merah;
individu yang Rhesus positif (Rh +) memiliki antigen ini pada sel darah merah
dan individu yang Rhesus negatif (Rh-) tidak. Saat melahirkan normal, trauma
persalinan atau komplikasi selama kehamilan, darah dari janin dapat memasuki
sistem ibu. Dalam kasus seorang ibu Rh-kompatibel dan anak, pencampuran darah
konsekuensial dapat menyadarkan ibu Rh- dengan antigen Rh pada sel-sel darah
anak Rh +, menempatkan sisa kehamilan, dan setiap kehamilan berikutnya,
beresiko untuk hemolitik penyakit pada bayi baru lahir.
Rho (D) antibodi imunoglobulin spesifik untuk
antigen manusia Rhesus D (RhD). [66] antibodi anti-RhD diberikan sebagai bagian
dari rejimen pengobatan prenatal untuk mencegah sensitisasi yang mungkin
terjadi saat seorang ibu Rhesus negatif memiliki janin Rhesus positif.
Pengobatan seorang ibu dengan antibodi Anti-RhD sebelum dan segera setelah
trauma dan pengiriman menghancurkan antigen Rh dalam sistem ibu dari janin.
Penting untuk dicatat bahwa ini terjadi sebelum antigen dapat merangsang sel B ibu
untuk "mengingat" antigen Rh dengan menghasilkan sel memori B. Oleh
karena itu, sistem kekebalan humoral dia tidak akan membuat antibodi anti-Rh,
dan tidak akan menyerang antigen Rhesus dari bayi saat ini atau berikutnya.
pengobatan Rho (D) Immune Globulin mencegah sensitisasi yang dapat menyebabkan
penyakit Rh, tapi tidak mencegah atau mengobati penyakit yang mendasari itu
sendiri.
Validasi Peraturan Produk Antibodi Monoklonal Untuk
Digunakan Manusia
Produksi
dan pengujian:
Secara tradisional, sebagian besar antibodi yang
diproduksi oleh garis sel hibridoma melalui mengekalkan sel yang memproduksi
antibodi oleh fusi kimia yang diinduksi dengan sel myeloma. Dalam beberapa
kasus, fusi tambahan jalur lain telah menciptakan "Triomas" dan
"quadromas". Proses manufaktur harus tepat dijelaskan dan divalidasi.
Studi validasi setidaknya harus mencakup:
Demonstrasi bahwa proses ini mampu menghasilkan
kualitas yang baik (proses harus divalidasi)
Efisiensi pemurnian antibodi (semua kotoran dan
virus harus dihilangkan)
Karakterisasi antibodi dimurnikan (karakterisasi
fisikokimia, sifat imunologi, aktivitas biologis, kontaminan, ...)
Penentuan studi virus izin
·
Sebelum uji klinis, studi keamanan produk dan
kelayakan harus dilakukan:
·
Pengujian keamanan produk: Sterility (bakteri dan
jamur), In vitro dan in vivo pengujian untuk virus adventif, pengujian
retrovirus murine ... data keamanan produk yang dibutuhkan sebelum memulai uji
kelayakan dalam kondisi serius atau segera mengancam jiwa, itu berfungsi untuk
mengevaluasi potensial berbahaya produk.
·
Pengujian kelayakan: Ini adalah studi percontohan
yang tujuan meliputi, antara lain, awal karakterisasi keselamatan dan bukti
awal konsep pada populasi pasien tertentu kecil (di vito atau dalam pengujian
vivo).
Studi praklinis:
·
Menguji reaktivitas silang antibodi: untuk menyorot
interaksi yang tidak diinginkan (toksisitas) antibodi dengan jaringan
sebelumnya ditandai. Penelitian ini dapat dilakukan secara in vitro
(Reaktivitas antibodi atau immunoconjugate harus ditentukan dengan jaringan
dewasa cepat-beku) atau in vivo (dengan appropriates model hewan). informasi
lebih lanjut tentang in vitro pengujian reaktivitas silang.
·
Praklinis farmakologi dan toksisitas pengujian: uji
keamanan praklinis antibodi dirancang untuk mengidentifikasi kemungkinan
toksisitas pada manusia, untuk memperkirakan kemungkinan dan keparahan efek
samping potensial pada manusia, dan untuk mengidentifikasi dosis awal dan dosis
eskalasi aman, bila memungkinkan.
·
Studi toksisitas hewan: pengujian toksisitas akut,
berulang-dosis pengujian toksisitas, jangka panjang pengujian toksisitas
http://www.animalresearch.info/en/drug-development/safety-testing/
·
Farmakokinetik dan farmakodinamik pengujian: Gunakan
untuk dosis klinis tentu, kegiatan antibodi (AUC, farmakodinamik,
biodistribusi, ...), evaluasi efek klinis potensial.
Sumber:
Wikipedia
Blog Riyawan